Regeneration des embryonalen Herzens
Regeneration of the embryonic heart
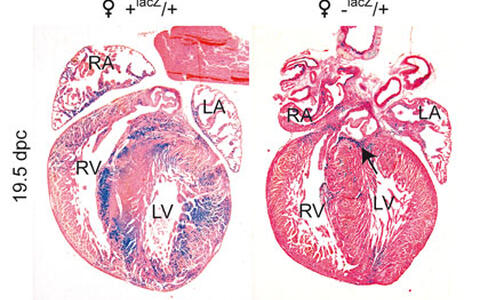
Abbildung 1. ß-Galaktosidase Färbung (blau) von fetalen Herzen im Stadium 19.5 dpc (days post coitum) unmittelbar vor der Geburt (Gegenfärbung mit Eosin, rosa). Das Kontroll-Herz (♀ +lacZ/+, heterozygot für ein X-chromosomales lacZ-Gen aber ohne den Hccs-KO) zeigt ausgedehnte Bereiche mit ß-Gal positiven und negativen Zellen als Folge der zufälligen X-chromosomalen Inaktivierung. In dem heterozygoten Hccs-KO-Weibchen (♀ -lacZ/+) ist das lacZ-Gen mit dem defekten Hccs-Allel gekoppelt, was die Detektion von Hccs-defizienten Zellen ermöglicht. Aufgrund der embryonalen Herzregeneration ist der Anteil von ß-Gal positiven (und somit Hccs-defizienten) Zellen am Aufbau des Herzgewebes bis zur Geburt minimiert. Nur wenige und meist isolierte Hccs-defiziente Zellen sind im ventrikulären bzw. atrialen Myokard zu sehen, wobei lediglich die Spitze des interventrikulären Septums eine Ansammlung von ß-Gal positiven Zellen zeigt (siehe Pfeil). RA = rechter Vorhof, LA = linker Vorhof, RV = rechter Ventrikel, LV = linker Ventrikel.
Das erwachsene Säuger-Herz wird als ein enddifferenziertes Organ ohne Fähigkeit zur Regeneration angesehen, so dass myokardiale Schäden im Verlauf verschiedener Herzerkrankungen zu einem irreversiblen Verlust von Herzmuskelzellen führen. Die Injektion von Stammzellen in geschädigtes Myokard sowie die Stimulation von im Herzen ansässigen kardialen Vorläuferzellen mit dem Ziel der Differenzierung dieser Zellen in Kardiomyozyten stellen dabei viel versprechende Therapiekonzepte dar, wobei die zugrunde liegenden molekularen und zellulären Mechanismen noch weitgehend unklar sind. Das embryonale Herz stellt dabei ein hervorragendes Model dar, um derartige Vorgänge zu untersuchen, da hier grundlegende Prozesse wie Proliferation und Differenzierung von Kardiomyozyten physiologischerweise ablaufen.
Im Rahmen dieses Projektes haben wir das X-chromosomal lokalisierte Gen für die Holocytochrom c Synthase (Hccs) im Mausmodell spezifisch im Herzen inaktiviert. Hccs kodiert für ein Enzym, das für den Ablauf der mitochondrialen Atmungskette und somit für die zelluläre Energiegewinnung essentiell ist, indem es die Aktivierung zweier Bestandteile der Elektronentransport-Kette (Cytochrom c und Cytochrom c1) katalysiert. Die aus dem Hccs-Mausmodell hervorgegangenen Ergebnisse zeigen zum ersten Mal eine beeindruckende regenerative Kapazität des embryonalen Herzens. Während die Inaktivierung von Hccs in hemizygoten männlichen Mäusen sowie homozygoten Weibchen embryonal letal ist und zu schweren Differenzierungsdefekten der Kardiomyozyten führt, entwickeln sich heterozygote Weibchen normal, überleben bis zur Geburt und zeigen auch danach in den meisten Fällen keinen kardialen Phänotyp. Aufgrund der zufälligen Inaktivierung eines der beiden X-Chromosomen in weiblichen Zellen würde man im Herzen heterozygoter Weibchen ein Mosaik aus Zellen erwarten, die entweder das mutierte X inaktivieren und daher normal sind oder solchen, die das gesunde X inaktivieren und damit den Defekt in der mitochondrialen Atmungskette tragen. Tatsächlich liegen in diesen Weibchen im Verlaufe der Embryonalentwicklung nach der Hälfte der Gestationszeit wie erwartet jeweils 50% gesunde und 50% Hccs-defiziente Zellen im Herzen vor. Der Anteil letzterer wird jedoch bis zur Geburt auf 10% reduziert, was durch eine Steigerung der Proliferationsrate in den normalen kardialen Zellen bedingt ist. Obwohl also in heterozygoten Hccs-Knock-Out-Weibchen in der frühen Embryonalentwicklung 50% der Zellen im Herzen funktionell defekt sind, kann die Population der gesunden Zellen bis zur Geburt ein funktionstüchtiges Herz regenerieren.
Die detaillierte Charakterisierung der der embryonalen Herzregeneration zugrunde liegenden molekularen Mechanismen und Signalketten sowie der beteiligten kardialen Zelltypen soll in nachfolgenden Untersuchungen neue Einblicke in Grundprinzipien der kardialen Regeneration, der embryonalen Herzentwicklung und ihrer Pathologie sowie in regenerative Therapieansätze von Herzerkrankungen liefern.
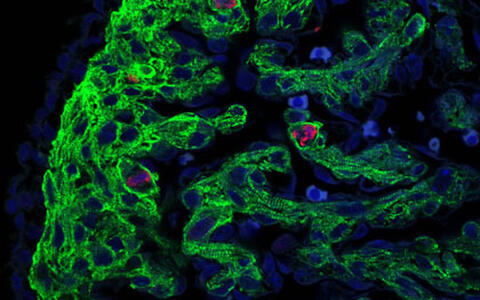
Abbildung 2. Immunfluoreszenz-Bild von proliferierenden Zellen im ventrikulären Myokard eines heterozygoten Hccs-KO-Embryos (Stadium 13.5 dpc) aufgenommen mit einem konfokalen Laser-Scanning Mikroskop. Kardiomyozyten sind mit Hilfe eines Antikörpers gegen das Sarkomer-Protein Troponin T grün markiert, während proliferierende Zellen in der Mitose durch einen Antikörper gegen die phosphorylierte Form von Histone H3 detektiert wurden (rot). Zellkerne wurden durch den DNA-Farbstoff DAPI gefärbt. Links im Bild liegt die ventrikuläre Kompaktschicht umgeben von Troponin T negativem Epikard, während sich die Trabekelschicht nach rechts ausdehnt und längliche, quer gestreifte Kardiomyozyten sowie Troponin T negative endokardiale Zellen zeigt. Das Bild bestätigt, dass die Mehrheit der proliferierenden Zellen im regenerierenden Myokard von heterozygoten Hccs-KO-Embryos tatsächlich Kardiomyozyten sind, nicht jedoch andere kardialen Zelltypen wie Fibroblasten bzw. endo- oder epikardiale Zellen.
Postnatale Ausreifung des Myokards nach durchgemachter embryonaler Entwicklungsstörung
Das oben beschriebene Model der embryonalen Herzregeneration impliziert, dass aus lediglich 50% der in der Embryonalentwicklung vorhandenen kardialen Zellen bis zur Geburt ein morphologisch völlig normales Herz generiert werden kann. Detaillierte Untersuchungen von Herzen in der Perinatal-Periode haben gezeigt, dass dies nicht der Fall ist. Obwohl die Herzfunktion in heterozygoten Hccs-Knock-Out-Weibchen ausreicht, um das Überleben in utero und auch nach der Geburt zu sichern, so zeigen sich im perinatalen Herzen doch klare Hinweise auf eine gestörte Entwicklung des ventrikulären Myokards. Beispielsweise zeigen heterozygote Hccs-Knock-out-Weibchen direkt vor der Geburt dünnere Wände beider Ventrikel im Vergleich zu Kontrollen sowie eine linksventrikuläre Non-Compaction, eine kardialer Veränderung, die sich durch eine dünne Kompaktschicht bei gleichzeitiger Hypertrabekularisierung des Myokards auszeichnet. Diese Veränderungen sind in adulten Stadien nicht mehr oder nur noch abgeschwächt nachweisbar, was darauf hindeutet, dass auch postnatal noch kardiale Ausreifungs- und Anpassungsvorgänge ablaufen, um die Folgen der gestörten embryonalen Entwicklung des Myokards zu kompensieren. Der auschlaggebende Mechanismus scheint dabei eine Hypertrophie der Kardiomyozyten in den Herzen heterozygoter Hccs-Knock-Out-Weibchen zu sein, was sowohl in Herzen von Neugeborenen als auch adulten Mäusen nachweisbar ist. Interessanterweise zeigen jedoch einige Neugeborene Hccs-KO-Weibchen lediglich eine milde zelluläre Hypertrophie, dafür aber eine deutlich gesteigerte Proliferation. Demzufolge scheinen beide Grundmechanismen des kardialen Wachstums bei der postnatalen Kompensation eine Rolle zu spielen.
Trotz der embryonalen Herzregeneration und der postnatalen Kompensationsvorgänge entwickelt ein kleiner Teil heterozygoter Hccs-KO-Weibchen mit zunehmendem Alter variabel kardiale Phänotypen, von Störungen des Reizleitungssystems bis hin zu massiver dilatativer Kardiomyopathie und plötzlichem Herztod. Dies deutet darauf hin, dass sowohl der Anteil an Hccs-defizienten Zellen am Herzgewebe und, möglicherweise noch wichtiger, die Lokalisation dieser Zellen innerhalb des Herzens für das Schicksal dieser Tiere verantwortlich sind.
Laufende Projekte
- Molekulare Untersuchungen der involvierten Stimulations-Faktoren und Signalketten bei der embryonalen Herzregeneration (Methoden: Expressions-Chips, Real-Time PCR, Immunfluoreszenz, in situ Hybridisierung)
- Identifizierung von an der embryonalen Herzregeneration beteiligten Zelltypen (Methoden: Zellkultur von embryonalen Herzzellen, Fluorescence Activated Cell Sorting (FACS), Gewebekultur von embryonalen Herzen)
- Molekulare Untersuchungen der Signalketten bei der postnatalen Ausreifung des Myokards (Methoden: Expressions-Chips, Real-Time PCR, Immunfluoreszenz, Stammzell-Techniken)
- Untersuchung der Herzfunktion im Verlauf der embryonalen Herzregeneration (Methoden: longitudinale echokardiographische Studien der Herzentwicklung)
- Untersuchungen zum Einfluss von verbliebenen Hccs-defizienten Zellen im adulten Herzen auf die Herzfunktion (Methoden: Echokardiographie, kardiale Stressmodelle, EKG)
- Untersuchung der Konsequenzen einer späten Inaktivierung von Hccs in fetalen und adulten Stadien im Hilfe von induzierbaren herzspezifischen Cre Mäusen
Mitarbeiter am Projekt:
Dr. med. Jörg-Detlef Drenckhahn (Projektleiter)
Manuela Magarin (naturwissenschaftliche Doktorandin)
Patrick Langner (Diplomand)
Susanne Probst (naturwissenschaftliche Doktorandin)
Publikationen:
Drenckhahn JD, Schwarz QP, Gray S, Laskowski A, Kiriazis H, Ming Z, Harvey RP, Du XJ, Thorburn DR, Cox TC (2008). Compensatory growth of healthy cardiac cells in the presence of diseased cells restores tissue homeostasis during heart development.
Developmental Cell 15 (4): 521-533.